Pengertian Konfigurasi Elektron, Sejarah, Elektron Valensi & Sistem Periodik Unsur. Penjelasan definisi konfigurasi elektron yang meliputi sejarah, elektron valensi dan hubungannya dengan sistem periodik unsur. Jika kita belajar mengenai kimia atom dan fisika kuantum, ada berbagai macam unsur yang membentuk berbagai macam hal di dunia ini. Dan saat ini, mari kita membahas mengenai konfigurasi elektron. Dimana kita akan membahas mengenai konfigurasinya, sejarahnya dan lain sebagainya.
Sebelumnya mungkin kalian juga ingin membaca materi kimia lainnya di ILMUPELAJARAN.COM seperti pengertian atom, ion, pembentukan dan macam ion; dan juga pengertian sifat kimia dan fisika, perbedaan, ciri-ciri & pemanfaatan di halaman lainnya.
Elektron sendiri memiliki siklus orbit pada tingkatan energi tertentu yang dapat kita sebut sebagai kulit. Dimana kulit elektron ini adalah sekelompok orbital yang memiliki tingkat energi yang sama. Dan selain adanya kulit, disana juga ada yang dinamakan sub kulit yang mana merupakan sekelompok orbital-orbital yang memiliki label sama, yakni nilai n dan l yang dimiliki adalah sama.
Sehingga pada tiga orbital 2p membentuk subkulit atau subkelopak. Dimana permodelan seperti ini dibuat pertama kali oleh Niels Bohr yang menjadi orang pertama yang mengusulkan perioditas pada tabel periodik yang dapat dijabarkan menggunakan struktur elektron pada atom.
Pengertian Konfigurasi Elektron
Konfigurasi elektron dapat disebut dan dipahami sebagai susunan elektron pada sebuah atom, molekul dan struktur fisik yang mendukung lainnya. Ini hampir sama dengan partikel elementer lainnya, dimana elektron adalah unsur yang mengikuti hukum mekanika kuantum dan menampilkan sifat-sifat partikel maupun gelombang.
Sejarah Konfigurasi Elektron
Seorang ilmuwan bernama Neils Bohr awalnya mengajukan model atom Bohr, yang mana memiliki kulit elektron berbentuk orbit yang berjarak tetap dari setiap inti atom. Awalnya Bohr membuat konfigurasi yang berbeda dengan yang kini umum digunakan, misalnya adalah sulfur berkonfigurasi 2.4.4.6 daripada 1s2 2s2 2p2 dan seterusnya.
Lalu satu tahun kemudian ilmuwan lain bernama E.C. Stoner memasukkan bilangan kuantum ketiga pada deskripsi kulit elektron dan dengan benar memprediksi struktur sulfur sebagai 2.8.6.
Namun walaupun sudah begitu, nyatanya Bohr ataupun Stoner sama sekali tidak ada yang dapat menjelaskan dengan baik perubahan spektra atom dan medan magnet. Maka kemudian setelah meminta bantuan Wolfgang Pauli, yang kemudian akhirnya menyadari bahwa efek Zeeman diakibatkan oleh elektron terluar atom. Bukan hanya itu, ia juga berhasil menghasilkan kembali struktur kulit stoner yang benar dengan memasukan sebuah bilangan dari kuantum keempat.
Persamaan lainnya yang dapat ditemukan, adalah hasil tiga bilangan yang berasal dari empat bilangan kuantum sebagai konsekuensi penyelesaian untuk atom Hidrogen.
BACA JUGA: METODE PEMISAHAN CAMPURAN LENGKAP DENGAN CONTOHNYA
Konfigurasi Elektron Berdasarkan Kulit Atom
Pada setiap kulit elektron, umumnya hanya akan terisi sejumlah tertentu dari elektron. Dimana jumlah maksimal elektron tersebut yang dapat terisi pada kulit elektron ke-n adalah 2n2 dan dimana n adalah merupakan nomor kulit atau bisa dibilang sebagai bilangan kuantum utama.
- Kulit K (n = 1) maksimal terisi 2 × 12 = 2 elektron.
- Kulit L (n = 2) maksimal terisi 2 × 22 = 8 elektron.
- Kulit M (n = 3) maksimal terisi 2 × 32 = 18 elektron.
- Kulit N (n = 4) maksimal terisi 2 × 42 = 32 elektron.
- Kulit O (n = 5) maksimal terisi 2 × 52 = 50 elektron.
Elektron-elektron yang ada akan selalu berusaha untuk mengisi kulit-kulit elektron pada atom. Ini dimulai dari kulit pertama yang terdekat dengan inti, yaitu kulit K yang juga merupakan level energi yang terendah.
Apabila kulit K telah dipenuhi dengan isi dari dua elektron, maka elektron itu akan mengisi kulit L. Dan setelah kulit L juga terisi penuh oleh 8 elektron, maka kemudian akan mengisi kulit M, N dan begitu pula seterusnya secara bertahap. Tetapi jumlah maksimum dari elektron yang ada pada kulit terluar (kulit valensi) dari suatu atom adalah 8.
Konfigurasi Elektron Model Mekanika Kuantum
Menurut model atom mekanika kuantum, elektron-elektron dalam atom bergerak mengelilingi inti pada tingkat-tingkat energi tertentu (kulit atom). Pada setiap kulit atom terdiri atas subkulit yang merupakan kumpulan orbital (tempat kemungkinan adanya elektron).
Dalam konfigurasi elektron model mekanika kuantum dikenal empat bilangan kuantum. Bilangan kuantum tersebut yang menjelaskan letak elektron-elektron suatu atom. Keempat bilangan kuantum tersebut adalah bilangan kuantum utama (n), azimuth (l), magnetik (m), dan spin (s).
Bilangan Kuantum Utama (n): menyatakan tingkat energi utama dengan nilai n = 1, 2, 3, 4, 5, 6, dan 7.
- n = 1 menyatakakan kulit pertama (K)
- n = 2 menyatakakan kulit pertama (L)
- n = 3 menyatakakan kulit pertama (M)
- dan seterusnya
Bilangan kuantum Azimuth (l): menyatakan bentuk orbital tempat elektron berada pada subkulit. Nilai bilangan azimut dimulai dari l = 0, 1, 2, 3, dan seterusnya.
- Nilai l = 0 menyatakan subkulit s
- Nilai l = 1 menyatakan subkulit p
- Nilai l = 2 menyatakan subkulit d
- Nilai l = 3 menyatakan subkulit f
Bilangan Kuantum Magnetik (m): menyatakan letak elektron pada suatu orbital. Nilai bilangan kuantum m adalah …,-1, 0, +1, …
- Untuk m = 0, subkulit s, m = 0 (terdapat 1 orbital)
- Untuk m = 1, subkulit p, m =-1, 0, + 1 (terdapat 3 orbital)
- Untuk m = 2, subkulit d, m = –2,-1, 0, + 1, +2 (terdapat 5 orbital)
- Untuk m = 3, subkulit f, m = –3, –2,-1, 0, + 1, +2, + 3 (terdapat 7 orbital)
Bilangan Kuantum Spin (s): menyatakan arah perputaran elektron. Nilai bilangan kuantum s adalah-1 dan + 1.
- s = +1 menyatakan arah putaran searah jarum jam dan digambarkan dengan tanda panah ke atas.
- s =-1 menyatakan arah putaran berlawanan arah jarum jam digambarkan dengan tanda panah ke arah bawah.
Bilangan kuantum yang biasa dicari adalah bilangan kuantum dari elektron dengan tingkat energi paling tinggi atau elektron paling akhir. Contoh pada atom Oksigen (nomor atom 8) dengan konfigurasi elektron 1s2 2s2 2p4. Elektron dengan tingkat paling tinggi berada pada orbital 2p4. Nilai masing-masing bilangan kuantum dari 2p4 adalah n = 2, l = 1, m =-1, dan s =-1\2.
Elektron Valensi
Elektron yang memiliki peran pada reaksi pembentukan ikatan kimia dan juga berperan pula dalam reaksi kimia adalah elektron terluar atau juga biasa disebut sebagai elektron valensi. Jumlah elktron valensi, dapat ditentukan berdasarkan dari jumlah elektron yang terdapat pada kulit terakhir yang berasal dari konfigurasi elektron atom tersebut. Unsur yang memiliki jumlah elektron valensi yang sama juga akan memiliki sifat kimia yang mirip.
Kaidah Penentuan Konfigurasi Elektron
Dalam penentuannya, ketika kita membahas mengenai konfigurasi sebuah atom, tidak bisa langsung dengan mudahnya melakukannya tanpa terlebih dahulu mengetahui aturan-aturannya. Dimana ada 3 aturan yang sebelumnya harus diperhitungkan terlebih dahulu yaitu diantaranya adalah asas aufbau, larangan pauli dan kaidah hund.
Asas Aufbau
Menurut aasas ini, bahwa elektron dalam atom sebisa mungkin memiliki energi terendah. Pengisian elektron yang ada pada orbital selalu dimulai dari orbital 1s atau tingkat energi terendah. Jika orbitas 1s sudah penuh, elektron akan masuk ke dalam orbital 2s, demikian seterusnya.
Asas Larangan Pauli
Asas larangan pauli menyebutkan tidak mungkin dalam sebuah atom ada dua elektron dengan harga keempat bilangan kuantum yang sama. Maksudnya, dalam sebuah atom, dua buah elektron mungkin memiliki harga n, l, dan ml yang sama, tetapi harga snya pasti berbeda.
Jadi, larangan pauli didalamnya menjelaskan bahwa sebuah orbital maksimum yang hanya dapat ditempati dua elektron yang arah spinnya berlawanan.
- Subkulit s punya 1 orbital, elektron maksimumnya 2.
- Subkulit p punya 3 orbital dan elektron maksimumnya 6
- Subkulit p punya 5 orbital dan elektron maksimumnya 10
- Subkulit p punya 7 orbital dan elektron maksimumnya 14
- Jumlah maksimum dari elektron yang ada pada kulit ke – n = 2n2.
Kaidah Hund
Pada pengisian orbital-orbital yang berenergi sama maka elektron akan menempati orbital secara sendiri-sendiri dengan spin yang paralel kemudian baru berpasangan. Keadaan energi terendah adalah yang memiliki elektron tak berpasangan yang paling banyak.
Konfigurasi Elektron Ion
Ion positif adalah ion yangterbentuk dari atom netral dengan melepas elktron pada kulit terluarnya.
Penulisannya biasanya sebagai berikut:
- Ion positif Lx+ yang artinya sedang melepaskan elektron sebanyak x.
- Ion negatif Ay– yang artinya sedang menangkap elektron sebanyak y.
- Ion negatif adalah ion yang terbentuk dari atom netral dengan menarik elektron untuk dapat mengisi orbit dari subkulit terluar yang belum penuh.
Hubungan Konfigurasi Elektron dengan Sistem Periodik Unsur
Konfigurasi elektron dengan sistem periodik unsur selalu memiliki kesinambungan yang saling berkaitan satu sama lainnya. Dari konfigurasi elektron yang ada pada suatu atom, dapat diperkirakan dimana letak unsur dalam tabel periodik. Konfigurasi yang dilakukan, sesungguhnya harus ditentukan dengan percobaan.
Percobaan bisa dilakukan dengan menentukan elektron valensi yang di dalamnya menunjukkan periode unsur dalam tabel periodik. Penentuan dari suatu golongan dapat dilihat dari elektron terakhir yang mengisi sub kulit. Contohnya adalah: elektron yang mengisi subkulit s pada sp yang terletak pada gol IA atau IIA, elektron yang mengisi subkulit p pada sp terletak di bagian gol IIIA sampai dengan VIIIA, jika elektron terakhir mengisi sub kulit d pada s terletak pada gol B.
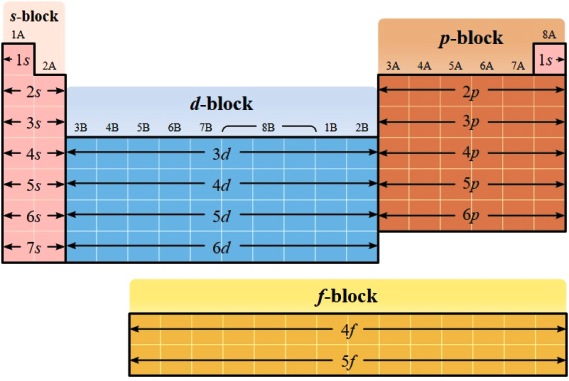
Konfigurasi elektron sangat erat hubungannya dengan sistem periodik unsur. Seperti yang telah kalian ketahui bahwa sifat-sifat unsur sangat tergantung pada jumlah elektron valensinya. Jika jumlah elektron luar yang mengisi orbital dalam subkulit sama dengan bilangan kuantum utama (n), maka atom unsur tersebut pasti terletak pada golongan yang sama (selain yang berbentuk ion). Sedangkan nilai n (bilangan kuantum utama) yang terbesar menunjuk nomor periode unsur tersebut dalam sistem periodic unsur. Misal konfigurasi elektron unsur K sebagai berikut:
19K : 1s2 2s2 2p6 3s2 3p6 4s1
Nilai n terbesar adalah 4, maka K menempati periode 4.
Untuk menentukan golongan unsur dalam sistem periodic berdasarkan konfigurasi elektron, perlu dilihat pada jenis dan jumlah elektron terluar yang menempati kulit yang sama.
- Golongan utama (Golongan A), pada golongan ini electron valensi menempati subkulit s atau subkulit s dan p.
- Golongan transisi (Golongan B), pada golongan ini electron valensi menempati subkulit s dan d.
- Untuk lantanida dan aktinida, elektron valensi menempati subkulit s dan f. Tapi jumlahnya tidak menentukan golongan, karena lantanida dan aktinida tidak mempunyai golongan.
Jika pengamatan kalian pada kegiatan mandiri benar, maka akan diketahui adanya hubungan antara konfigurasi elektron atom unsur-unsur dengan sistem periodik, baik mengenai golongan maupun periodenya. Sehingga dapat dikatakan bahwa sistem periodik dapat digunakan untuk meramalkan konfigurasi elektron atom unsur-unsur.
Pembagian unsur-unsur menurut blok s , p, d, dan f
Berdasarkan kesamaan konfigurasi elektron, terluar dapat dikelompokan unsur-unsur tersebut dalam blok berikut.
- Blok s. Unsur yang mempunyai konfigurasi elektron terluar pada orbital s terletak pada golongan IA dan IIA, kecuali unsur H dan He. Unsur-unsur ini merupakan logam yang reaktif. Misal konfigurasi elektron terluar adalah nsx, maka unsur tersebut terletak pada golongan xA.
- Blok p. Unsur yang mempunyai konfigurasi elektron terluar pada orbital p, terdapat dalam golongan IIIA, IVA, VA, VIA, VIIA, dan VIII. Golongan unsur-unsur ini meliputi logam, metaloid, dan non logam. Misal konfigurasi elektron terluar adalah npy, maka unsur tersebut terletak pada golongan (2 + y)A.
- Blok d. Konfigurasi elektron terluar d terdapat dalam unsurunsur transisi, yaitu golongan IIIB, IVB, VB, VIB, VIIB, VIIIB, IB, dan IIB. Misal konfigurasi elektron terluar adalah nsx (n-d)z, maka unsur tersebut terletak pada golongan (x + z)B. Jika:
- x + z = 8, x + z = 9, dan x + z = 10, maka unsur terletak pada golongan VIIIB;
- x + z = 11, maka unsur terletak pada golongan IB;
- x + z = 12, maka unsur terletak pada golongan IIB.
- Blok f. Blok ini merupakan golongan unsur lantanida dan aktinida. Golongan ini disebut juga golongan transisi dalam.
Demikianlah penjelasan lengkap mengenai konfigurasi elektron termasuk hubungannya dengan sistem periodik unsur. Jangan lewatkan materi pelajaran lainnya, yaitu pengertian larutan, macam-macam larutan dan kesetimbangan kimia yang sangat menarik untuk dipelajari.
 ILMUPELAJARAN.COM Kumpulan Informasi Bermanfaat
ILMUPELAJARAN.COM Kumpulan Informasi Bermanfaat







